
M371-Test | Die Zukunft der Hodenkrebsdiagnostik
Der innovative M371-Test von mir|detect detektiert die tumorspezifische miR-371a-3p mittels einer minimal-invasiven Blutabnahme.


Hintergrund
Biotracing
Bisherige Standarddiagnostik
Hodenkrebs ist die am häufigsten auftretende Krebserkrankung bei Männern im Alter zwischen 20 und 45 Jahren. In Europa allein gibt es jährlich 25.000 neue Fälle und weltweit betrachtet etwa 60.000 neue Erkrankungsfälle pro Jahr.
Herkömmliche Serumtumormarker liefern aufgrund ihrer geringen Sensitivität und Spezifität nur wenig zuverlässige Ergebnisse, sodass erhebliche Unsicherheiten bestehen bleiben.
Zudem werden die positiv getesteten und operierten Patienten im Rahmen der Nachsorge einer erheblichen zytotoxischen Strahlenbelastung durch Computer-Tomographie-Scans (CT-Scans) ausgesetzt. Die alternative Nutzung von Magnetresonanztomographie (MRT) zur Bildgebung vermeidet zwar die Strahlenexposition, jedoch verursacht die MRT auch immense Kosten im Gesundheitswesen. Vor dem Hintergrund, dass ein Hodenkrebs-Patient nach Erstdiagnose über einen Zeitraum von bis zu 10 Jahren wiederkehrend (durchschnittlich bis zu 19-mal) untersucht werden muss, was 2 bis 4 bildgebende Untersuchungen pro Jahr beinhaltet (CT), wird deutlich, dass dies mit einer erheblichen Belastung des Patienten und auch des Gesundheitswesens einhergeht.
Durch den Einsatz des M371-Tests kann der Einsatz von CT- und MRT-Untersuchungen erheblich reduziert werden.
Die innovative Neuentwicklung detektiert die tumorspezifische miR-371a-3p in minimal-invasiv gewonnenen Blutproben. Die Konzentration der miRNA in einer Blutprobe wird durch eine quantitative Real-Time PCR bestimmt. Die Sensitivität und Reproduzierbarkeit dieser Methode zum Nachweis der oft in geringer Konzentration vorhandenen miRNAs wird durch eine vorgeschaltete Präamplifikation gesteigert.

Technologie
Biotracing
SO FUNKTIONIERT UNSER HOCHLEISTUNGS-TUMOR-TEST
mir|detect hat die innovative und patentierte panta|Q®-Technologie entwickelt, um die Sensitivität und Reproduzierbarkeit von Nukleinsäure-Amplifikationstests (NAT) in der Diagnostik zu verbessern. Der M371-Test, entwickelt von mir|detect basierend auf der panta|Q®-Technologie, quantifiziert die für Hodenkrebs spezifische miR-371a-3p, welche von den Tumorzellen abgegeben wird und in der Blutprobe des Patienten nachweisbar ist. Die Bestimmung der Konzentration der keimzelltumorspezifischen miR-371a-3p liefert eine zuverlässige Aussage über das Vorhandensein von Hodenkrebs. Die Sensitivität und Spezifität dieses Verfahrens übertrifft die Aussagekraft der klassischen Serumtumormarker deutlich.

Die panta|Q®-Technologie
Die von mir|detect entwickelte und patentierte panta|Q®-Technologie setzt neue Maßstäbe in Sensitivität und Robustheit beim Nachweis krankheitsspezifischer Nukleinsäuren. Die Technologie verfügt über einen weitreichenden Patentschutz und ermöglicht den Aufbau eines breiten Spektrums an Nukleinsäure-basierten Tests.
Haben Sie Interesse, die panta|Q®-Technologie auch für Ihr In-vitro Diagnostikum zu nutzen? Kontaktieren Sie uns!
Unser M371-Test hat das Potenzial, den Diagnose- und Behandlungsprozess für Hodenkrebs-Patienten, medizinisches Personal und Versicherungen auf jeder Ebene zu verbessern. Der Test ermöglicht eine schnellere und individuellere Therapieentscheidung und damit nicht zuletzt auch die Möglichkeit, Kosten einzusparen. Durch die Erkennung von kleinsten Mengen der tumorspezifischen miR-371a-3p in einer Blutprobe kann der M371-Test auch in der Primärdiagnostik eingesetzt werden, um schneller und sicherer eine klare Diagnose zu stellen.
DIAGNOSTIK & Therapieerfolg
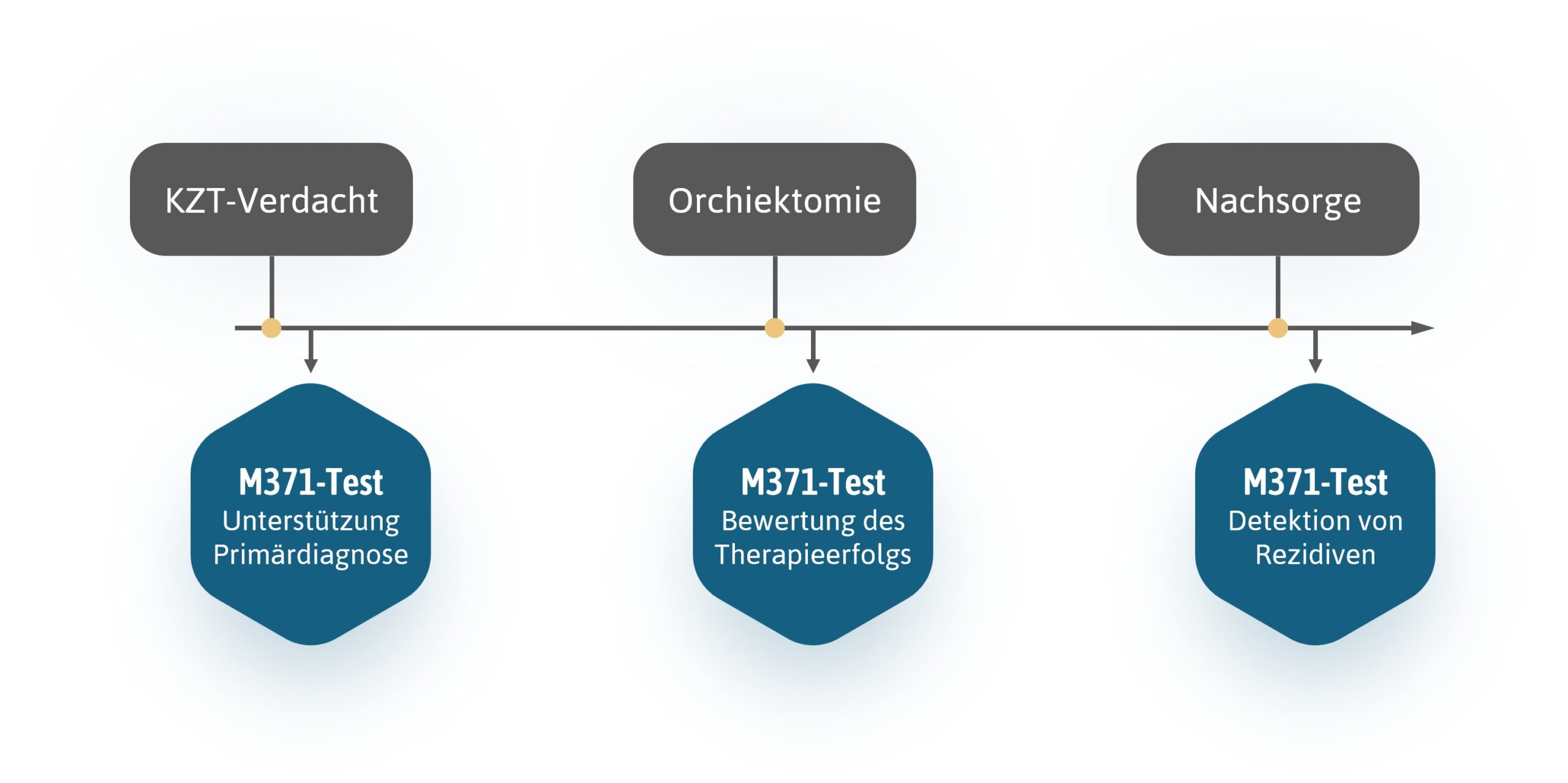
Der M371-Test ist neben der Primärdiagnostik auch insbesondere in der Überwachung des Therapieerfolgs von großer Bedeutung.

Durch die frühzeitige Erkennung der tumorspezifischen miR-371a-3p in Blutproben können Ärzte schneller und effektiver Hodenkrebs sicher diagnostizieren und den Erfolg therapeutischer Maßnahmen überwachen. Der M371-Test kann verbleibende Tumormassen anzeigen und den Patienten eine personalisierte Behandlung ermöglichen.

NACHSORGE
Nach einer erfolgreichen Behandlung folgt die Nachsorge, die im Fall von Hodenkrebs bis zu 10 Jahre dauern kann. Der M371-Test kann verwendet werden, um Veränderungen im Gesundheitszustand engmaschig zu überwachen.
Aufgrund der hohen Rezidivrate von Hodenkrebs ist nach einer erfolgreichen Erstbehandlung eine langjährige Nachsorge über einen Zeitraum von bis zu 10 Jahren erforderlich. Der M371-Test erkennt wiederauftretende Tumoren in dieser Phase zuverlässig und frühzeitig. Dies ermöglicht die rechtzeitige Einleitung einer Therapie und erhöht damit die Wahrscheinlichkeit auf ihren Erfolg. Durch einen Verzicht auf strahlenintensive Untersuchungsmethoden (CT) kann gleichzeitig das Risiko für sekundäre Krebserkrankungen reduziert werden.

Anwendung
Biotracing
SO KOMMT der M371-Test ZUM EINSATZ
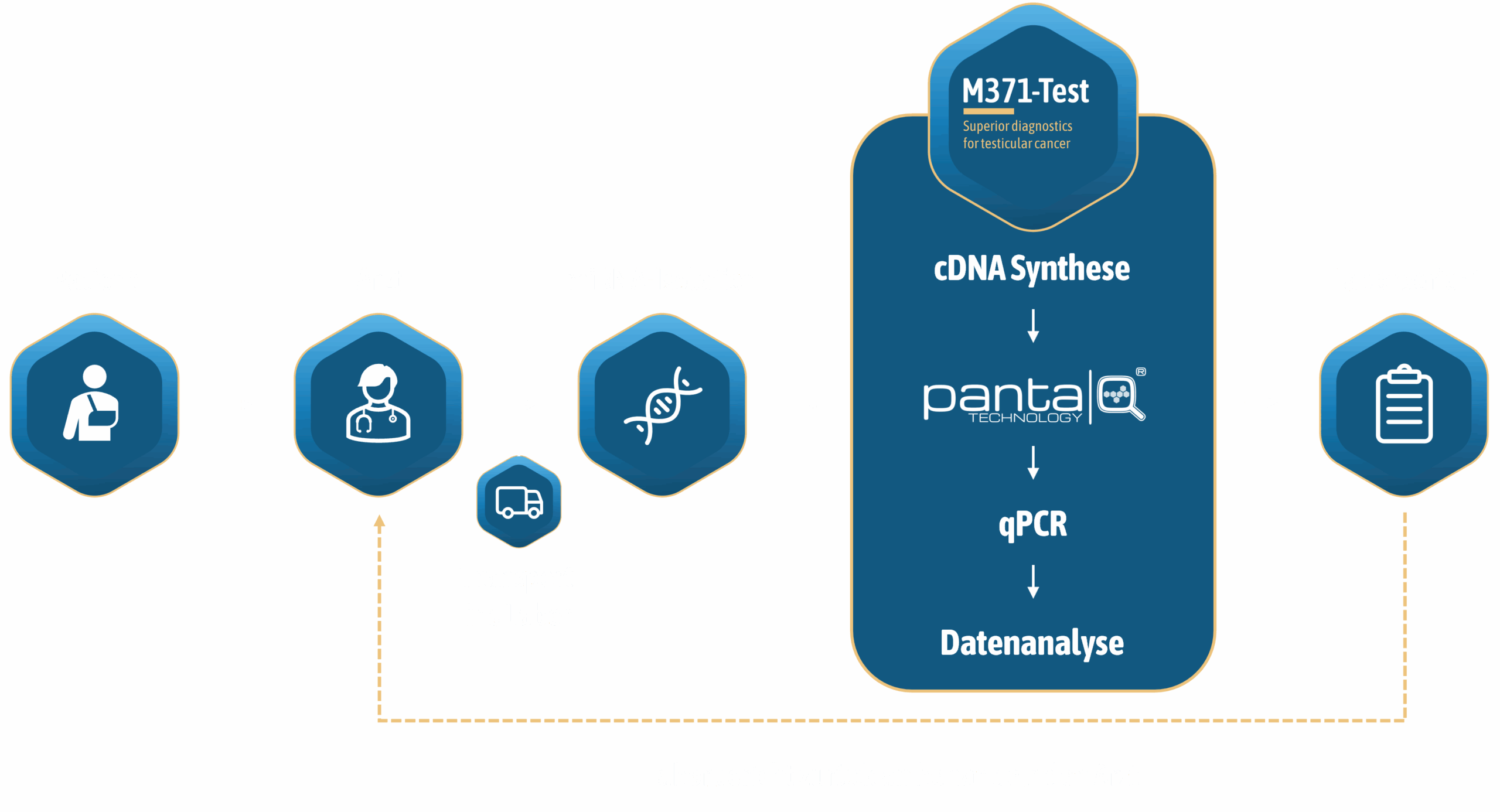

Studien & mehr
Biotracing
Klinische Studien zur Eignung des M371-Tests in der Hodenkrebsdiagnostik
Einsatz in der Primärdiagnostik
Die Eignung des M371-Test für die Primärdiagnostik wurde in einer multizentrischen klinischen Studie evaluiert, an der 37 Zentren in mehreren europäischen Ländern teilnahmen (DE, AT, CH, IT, HU).
Aufgrund ihres großen Umfangs mit 522 Patienten (nur Primärdiagnostik) und 258 Kontrollprobanden besitzt diese Studie eine hohe Aussagekraft. Der M371-Test erzielte mit einer Sensitivität von 90 % und einer Spezifität von 94 % hervorragende Ergebnisse und erwies sich den klassischen Serumtumormarkern als deutlich überlegen (Dieckmann et al., 2019).
Einsatz in der Nachsorge
Zur Eignung des M371-Tests in der Nachsorge von Hodenkrebspatienten liegt eine umfangreiche, prospektive Studie vor. In dieser Studie wurden 258 Patienten über einen Zeitraum von bis zu 48 Monaten (Median: 18 Monate) nachbeobachtet. Im Beobachtungszeitraum traten 39 Rezidive (15 %) auf. Das Ergebnis des M371-Tests war in all diesen Fällen positiv, woraus sich eine Sensitivität von 100 % ergibt. Die Serumtumormarker AFP und ß-hCG erzielten dagegen in Kombination eine Sensitivität von lediglich 45 % (Belge et al., 2024).
Leistungsdaten zum M371-Test
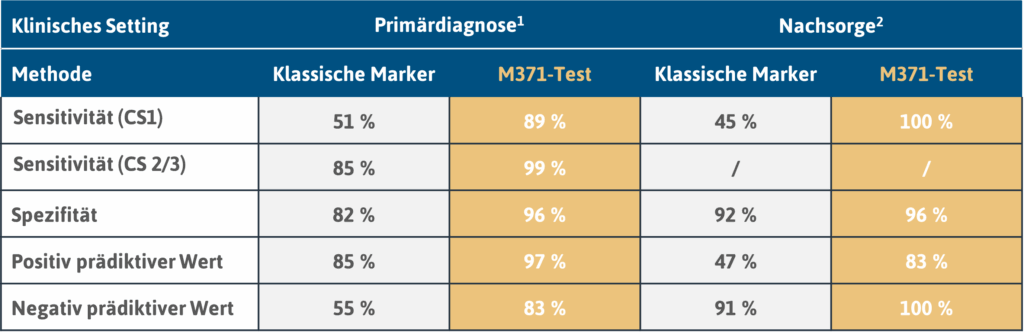
1 n = 522 Patienten; 258 Kontrollen (Dieckmann et al., 2019; https://doi.org/10.1200/jco.18.01480)
2 n = 258 Patienten (Belge et al., 2024; https://doi.org/10.1158/1078-0432.ccr-23-0730)
Klassische Marker: AFP (α-fetoprotein), bHCG (β-subunit of human chorionic gonadotropin) und LDH (lactate dehydrogenase)
Ausgewählte Publikationen
AUSGEWÄHLTE PUBLIKATIONEN
Dieckmann KP, Radtke A, Geczi L, Matthies C, Anheuser P, Eckardt U, Sommer J, Zengerling F, Trenti E, Pichler R, Belz H, Zastrow S, Winter A, Melchior S, Hammel J, Kranz J, Bolten M, Krege S, Haben B, Loidl W, Ruf CG, Heinzelbecker J, Heidenreich A, Cremers JF, Oing C, Hermanns T, Fankhauser CD, Gillessen S, Reichegger H, Cathomas R, Pichler M, Hentrich M, Eredics K, Lorch A, Wülfing C, Peine S, Wosniok W, Bokemeyer C, Belge G. 2019. Serum Levels of MicroRNA-371a-3p (M371 Test) as a New Biomarker of Testicular Germ Cell Tumors: Results of a Prospective Multicentric Study. J Clin Oncol. 37: 1412-1423. https://doi.org/10.1200/jco.18.01480
Belge G, Dumlupinar C, Nestler T, Klemke M, Törzsök P, Trenti E, Pichler R, Loidl W, Che Y, Hiester A, Matthies C, Pichler M, Paffenholz P, Kluth L, Wenzel M, Sommer J, Heinzelbecker J, Schriefer P, Winter A, Zengerling F, Kramer MW, Lengert M, Frey J, Heidenreich A, Wülfing C, Radtke A, Dieckmann KP. 2024. Detection of Recurrence through microRNA-371a-3p Serum Levels in a Follow-up of Stage I Testicular Germ Cell Tumors in the DRKS-00019223 Study. Clin Cancer Res. 30: 404-412. https://doi.org/10.1158/1078-0432.ccr-23-0730
Sohaib SA, Koh DM, Husband JE. 2008. The role of imaging in the diagnosis, staging, and management of testicular cancer. AJR Am J Roentgenol. 191: 387-395. https://doi.org/10.2214/ajr.07.2758
Dieckmann KP, Belge G. 2024. Hodentumor – welche Vorteile bringt der neue Tumormarker microRNA-371a-3p (M371-Test). Aktuelle Urol. 55: 510-519. https://doi.org/10.1055/a-2358-8355
Leão R, van Agthoven T, Figueiredo A, Jewett MAS, Fadaak K, Sweet J, Ahmad AE, Anson-Cartwright L, Chung P, Hansen A, Warde P, Castelo-Branco P, O’Malley M, Bedard PL, Looijenga LHJ, Hamilton RJ. 2018. Serum miRNA Predicts Viable Disease after Chemotherapy in Patients with Testicular Nonseminoma Germ Cell Tumor. J Urol. 200: 126-135. https://doi.org/10.1016/j.juro.2018.02.068
Tavares NT, Henrique R, Jerónimo C, Lobo J. 2025. Current Role of MicroRNAs in the Diagnosis and Clinical Management of Germ Cell Tumors. Surg Pathol Clin. 18: 91-100. https://doi.org/10.1016/j.path.2024.08.003
Spiekermann M, Belge G, Winter N, Ikogho R, Balks T, Bullerdiek J, Dieckmann KP. 2015. MicroRNA miR-371a-3p in serum of patients with germ cell tumours: evaluations for establishing a serum biomarker. Andrology. 3: 78-84. https://doi.org/10.1111/j.2047-2927.2014.00269.x
Dieckmann KP, Radtke A, Spiekermann M, Balks T, Matthies C, Becker P, Ruf C, Oing C, Oechsle K, Bokemeyer C, Hammel J, Melchior S, Wosniok W, Belge G. 2017. Serum Levels of MicroRNA miR-371a-3p: A Sensitive and Specific New Biomarker for Germ Cell Tumours. Eur Urol. 71: 213-220. https://doi.org/10.1016/j.eururo.2016.07.029
Lobo J, Gillis AJM, van den Berg A, Dorssers LCJ, Belge G, Dieckmann KP, Roest HP, van der Laan LJW, Gietema J, Hamilton RJ, Jerónimo C, Henrique R, Salvatori D, Looijenga LHJ. 2019. Identification and Validation Model for Informative Liquid Biopsy-Based microRNA Biomarkers: Insights from Germ Cell Tumor In Vitro, In Vivo and Patient-Derived Data. Cells. 8: 1637. https://doi.org/10.3390/cells8121637
Leão R, Albersen M, Looijenga LHJ, Tandstad T, Kollmannsberger C, Murray MJ, Culine S, Coleman N, Belge G, Hamilton RJ, Dieckmann KP. 2021. Circulating MicroRNAs, the Next-Generation Serum Biomarkers in Testicular Germ Cell Tumours: A Systematic Review. Eur Urol. 80: 456-466. https://doi.org/10.1016/j.eururo.2021.06.006
Syring I, Bartels J, Holdenrieder S, Kristiansen G, Müller SC, Ellinger J. 2015. Circulating serum miRNA (miR-367-3p, miR-371a-3p, miR-372-3p and miR-373-3p) as biomarkers in patients with testicular germ cell cancer. J Urol. 193: 331-337. https://doi.org/10.1016/j.juro.2014.07.010
Radtke A, Hennig F, Ikogho R, Hammel J, Anheuser P, Wülfing C, Belge G, Dieckmann KP. 2018. The Novel Biomarker of Germ Cell Tumours, Micro-RNA-371a-3p, Has a Very Rapid Decay in Patients with Clinical Stage 1. Urol Int. 100: 470-475. https://doi.org/10.1159/000488771
Nazzani S, Busico A, Bernasconi V, Bruniera M, Gianninò M, Rusconi D, Gualtieri J, Silvani C, Macchi A, Torelli T, Stagni S, Tesone A, Saitta C, Capone I, Cascella T, Lanocita R, Barella M, Paolini B, Perrone F, Albo G, Catanzaro MA, Biasoni D, Montanari E, Nicolai N; Italian Germ Cell Cancer Group. 2025. Clinical evaluation of the role of miRNA 371 in small testicular masses. Results of the „S1STeM 371“ Trial. Eur J Cancer. 223: 115494. https://doi.org/10.1016/j.ejca.2025.115494
Fankhauser CD, Wettstein MS, Christiansen AJ, Rothermundt C, Cathomas R, Kaufmann E, Sigg S, Templeton AJ, Hirschi-Blickenstorfer A, Lorch A, Gillessen S, Beyer J, Hermanns T. 2024. Cut-offs for relapse detection in men with stage I testicular germ cell tumors during active surveillance within a prospective multicentre cohort study using either raw or housekeeper normalized miR-371a-3p serum levels. Urol Oncol. 42: 455.e9-455.e13. https://doi.org/10.1016/j.urolonc.2024.07.013
Spezifikationen: Das macht den M731-Test besonders
Was macht den M371-Test so besonders?
- Keine gesundheitliche Belastung für den Patienten im Vergleich zu anderen diagnostischen Methoden
- Höhere Verlässlichkeit durch sehr hohe Sensitivität (90,1 %)
- Schnellere und sicherere Abgrenzung von Keimzelltumoren zu anderen Erkrankungen durch die hohe Spezifität des M371-Tests (94 %)
- Schnellere Gewissheit durch eine rasche Normalisierung des miR-371a-3p-Spiegels nach der Behandlung
- Verbesserte Effizienz des Gesundheitssystems durch schnellere Diagnosen
- Unkomplizierte Integration in den klinischen Alltag, da Blutabnahme zur Routineuntersuchung gehört
- Einfache Etablierung in molekular-biologischen Laboren
M371-Test - möglicher Behandlungsverlauf
M371-Test - Spezifikationen
- Ready-to-use Reagenzien; alle für den Test benötigten Reagenzien sind enthalten
-
Validiert für die folgenden qPCR Cycler:
LightCycler® 480 II qPCR Instrument (Roche Diagnostics) mit 96-Well Heizblock
cobas z 480 qPCR Instrument (Roche Diagnostics) mit 96-Well Heizblock
LightCycler PRO qPCR Instrument (Roche Diagnostics) mit 96-Well Heizblock
QuantStudio™ 5 Dx (Thermo Fisher Scientific) mit 96-Well Heizblock
QuantStudio™ 5 (Thermo Fisher Scientific) mit 96-Well Heizblock
AriaDx (Agilent Technologies) mit 96-Well Heizblock
CFX96 qPCR instrument (BioRad) mit 96-Well Heizblock -
Empfohlene RNA Extraktions-Kits:
miRNeasy Serum/Plasma Kit (50) (QIAGEN GmbH)
Maxwell RSC miRNA Plasma or Serum Kit (Promega GmbH) - Einfacher Workflow
- Lagerung bei -23 to -15°C
Weitere Informationen zu Liquid Biopsy
Liquid Biopsy
Liquid Biopsy (engl. für Flüssig-Biopsie) bezeichnet ein diagnostisches Verfahren, bei dem Körperflüssigkeiten auf Stoffe untersucht werden, die spezifisch für eine Erkrankung sind. Diese Stoffe werden als „Biomarker“ oder „Marker“ bezeichnet.
Von Tumoren abgegebene Nukleinsäuren, die in Form von frei zirkulierenden Tumorzellen, freier DNA (auch cfDNA genannt) oder als Exosomen (kleine Vesikel, die z. B. miRNA transportieren) vorliegen können, sind als Biomarker für Tumorerkrankungen nutzbar. Als Probe können kleine Mengen Blut, Blutserum, Blutplasma, Urin oder ähnliche Materialien dienen.
Vorteile des Liquid Biopsy Verfahrens:
- Minimal-invasiv im Gegensatz zu anderen diagnostischen Methoden
- Die Identifikation von tumorspezifischen Molekülen erlaubt eine besonders frühe Erkennung von Tumorerkrankungen
- Effektives Monitoring von Therapieeffekten
- Frühere Erkennung von Rezidiven in der Nachsorge
Weitere Informationen zu qPCR
Der M371-Test basiert auf der Methode der quantitativen Real-Time PCR (qPCR)
Als qPCR (Real Time-quantitative Polymerase Chain Reaction) wird eine molekulardiagnostische Methode bezeichnet, die zum Nachweis und zur Quantifizierung von Nukleinsäuren (DNA oder RNA) dient.
Die Polymerase-Kettenreaktion vervielfältigt die nachzuweisenden Nukleinsäuren (Amplifikation). Bei der qPCR wird zudem eine fluoreszenzmarkierte Sonde verwendet. Im Ausgangszustand verhindert ein ebenfalls an die Sonde gebundenes Molekül eine Emission der Fluorophore. Im Verlauf der PCR zerfällt die Sonde durch die enzymatische Aktivität einer DNA-Polymerase. In diesem Zustand wird die Fluoreszenz nicht mehr absorbiert, und bei Anregung durch Licht wird ein Fluoreszenzsignal detektierbar. Je mehr der Ziel-Nukleinsäure in einer Probe vorhanden ist, desto früher wird dieses Signal messbar. Der Zeitpunkt des Erreichens eines Schwellwertes gibt somit Auskunft über die Konzentration des Zielmoleküls in der Probe.
Die Kombination der qPCR mit einer vorgeschalteten Präamplifikation erhöht die Sensitivität des M371-Tests, sodass auch kleinste Mengen der tumorspezifischen miRNA nachweisbar sind. Dieses von mir|detect entwickelte und optimierte Verfahren ist patentrechtlich geschützt.

